Чалавечы бэта-амілаід (1-42) бялок, таксама вядомы як Aβ 1-42, з'яўляецца ключавым фактарам у раскрыцці таямніц хваробы Альцгеймера.Гэты пептыд гуляе цэнтральную ролю ў фарміраванні амілаідных бляшак, загадкавых кластараў, якія пашкоджваюць мозг пацыентаў з хваробай Альцгеймера.Маючы разбуральны эфект, ён парушае сувязь нейронаў, выклікае запаленне і выклікае нейротоксичность, што прыводзіць да кагнітыўных парушэнняў і пашкоджання нервовай сістэмы.Даследаванне механізмаў агрэгацыі і таксічнасці не толькі жыццёва важна;гэта захапляльнае падарожжа да вырашэння галаваломкі хваробы Альцгеймера і распрацоўкі будучых метадаў лячэння.



Aβ 1-42 - гэта пептыдны фрагмент з 42 амінакіслот, які ўтвараецца ў выніку расшчаплення бялку-папярэдніка амілаіду (АРР) β- і γ-сакрэтазамі.Aβ 1-42 з'яўляецца адным з асноўных кампанентаў амілаідных бляшак, якія назапашваюцца ў галаўным мозгу пацыентаў з хваробай Альцгеймера, нейрадэгенератыўным захворваннем, якое характарызуецца кагнітыўнымі парушэннямі і стратай памяці.Было паказана, што Aβ 1-42 мае розныя функцыі і прымяненне ў біялагічных і біямедыцынскіх даследаваннях, такіх як:
1.Нейротоксичность: Aβ 1-42 можа ўтвараць растваральныя алігамеры, якія здольныя звязвацца і парушаць функцыю мембран нейронаў, рэцэптараў і сінапсаў.Гэтыя алігамеры таксама могуць выклікаць акісляльны стрэс, запаленне і апоптоз у нейронах, што прыводзіць да страты сінаптычнай сістэмы і гібелі нейронаў.Алігамеры Aβ 1-42 лічацца больш нейратаксічнымі, чым іншыя формы Aβ, такія як Aβ 1-40, які з'яўляецца самай распаўсюджанай формай Aβ у галаўным мозгу.Лічыцца таксама, што алігамеры Aβ 1-42 здольныя распаўсюджвацца ад клеткі да клеткі, падобна прыёнам, і выклікаць няправільнае згортванне і агрэгацыю іншых бялкоў, такіх як тау, які ўтварае нейрафібрылярныя клубкі пры хваробы Альцгеймера.
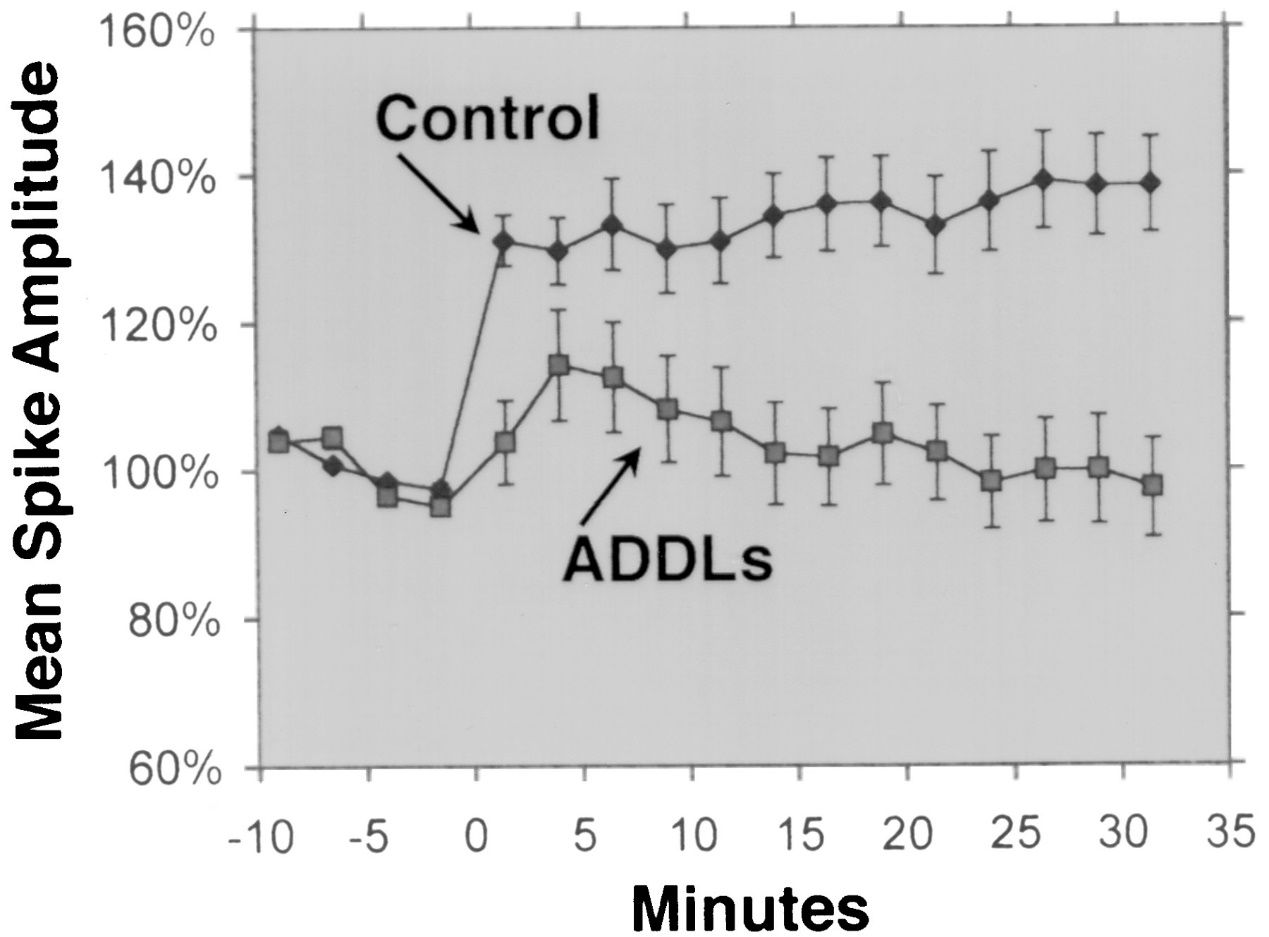
Aβ 1-42 шырока разглядаецца як ізаформа Aβ з самай высокай нейротоксичностью.Некалькі эксперыментальных даследаванняў прадэманстравалі нейратаксічнасць Aβ 1-42 з выкарыстаннем розных метадаў і мадэляў.Напрыклад, Lesné et al.(Brain, 2013) даследавалі адукацыю і таксічнасць алігамераў Aβ, якія ўяўляюць сабой растваральныя агрэгаты манамераў Aβ, і паказалі, што алігамеры Aβ 1-42 аказваюць больш моцны пашкоджвальны эфект на нейрональныя сінапсы, што прыводзіць да зніжэння кагнітыўных здольнасцей і страты нейронаў.Ламберт і інш.(Proceedings of the National Academy of Sciences, 1998) падкрэслілі нейратаксічнасць алігамераў Aβ 1-42 і выявілі, што яны аказваюць моцны таксічны эфект на цэнтральную нервовую сістэму, магчыма, уплываючы на сінапсы і нейрамедыятары.Уолш і інш.(Nature, 2002) паказалі інгібіруючы эфект алігамераў Aβ 1-42 на доўгатэрміновае патэнцыяванне гіпакампа (LTP) in vivo, якое з'яўляецца клеткавым механізмам, які ляжыць у аснове навучання і памяці.Гэта тармажэнне было звязана з парушэннем памяці і навучання, падкрэсліваючы ўплыў алігамераў Aβ 1-42 на сінаптычную пластычнасць.Шанкар і інш.(Nature Medicine, 2008) вылучыў дымеры Aβ 1-42 непасрэдна з галаўнога мозгу з хваробай Альцгеймера і паказаў іх уплыў на сінаптычную пластычнасць і памяць, падаючы эмпірычныя доказы нейратаксічнасці алігамераў Aβ 1-42.
Акрамя таго, Су і соавт.(Molecular & Cellular Toxicology, 2019) правялі транскрыптамічны і пратэёмічны аналіз нейротаксічнасці, выкліканай Aβ 1-42, у клетках нейрабластомы SH-SY5Y.Яны ідэнтыфікавалі некалькі генаў і бялкоў, на якія ўплывае Aβ 1-42 у шляхах, звязаных з працэсам апоптозу, трансляцыяй бялку, катабалічным працэсам цАМФ і адказам на стрэс эндаплазматычнага рэтыкулума.Такеда і інш.(Biological Trace Element Research, 2020) даследавалі ролю пазаклеткавага Zn2+ у нейротаксічнасці, выкліканай Aβ 1-42, пры хваробы Альцгеймера.Яны паказалі, што індукаваная Aβ 1-42 ўнутрыклеткавая таксічнасць Zn2+ паскараецца са старэннем з-за ўзроставага павелічэння пазаклеткавага Zn2+.Яны выказалі здагадку, што Aβ 1-42, які пастаянна вылучаецца з канчаткаў нейронаў, выклікае ўзроставае зніжэнне кагнітыўных функцый і нейрадэгенерацыю праз унутрыклеткавую дысрэгуляцыю Zn2+.Гэтыя даследаванні паказваюць, што Aβ 1-42 з'яўляецца ключавым фактарам у апасродкаванні нейратаксічнасці і прагрэсаванні хваробы пры хваробы Альцгеймера, уплываючы на розныя малекулярныя і клеткавыя працэсы ў галаўным мозгу.
2. Антымікробнае дзеянне: Паведамляецца, што Aβ 1-42 валодае антымікробнай актыўнасцю супраць розных узбуджальнікаў, такіх як бактэрыі, грыбкі і вірусы.Aβ 1-42 можа звязвацца з мембранамі мікробных клетак і разбураць іх, што прыводзіць да іх лізісу і гібелі.Aβ 1-42 можа таксама актываваць прыроджаную імунную сістэму і прыцягваць запаленчыя клеткі да месца інфекцыі.Некаторыя даследаванні паказваюць, што назапашванне Aβ у галаўным мозгу можа быць ахоўнай рэакцыяй на хранічныя інфекцыі або траўмы.Аднак празмерная або нерэгуляваная выпрацоўка Aβ можа таксама выклікаць пабочнае пашкоджанне клетак і тканак гаспадара.
Паведамляецца, што Aβ 1-42 праяўляе антымікробную актыўнасць супраць шэрагу патагенных мікраарганізмаў, такіх як бактэрыі, грыбы і вірусы, такія як залацісты стафілакок, кішачная палачка, Candida albicans і вірус простага герпесу тыпу 1, узаемадзейнічаючы з іх мембранамі і выклікаючы іх разбурэнне і лізіс.Кумар і інш.(Journal of Alzheimer's Disease, 2016) прадэманстраваў гэты эфект, паказаўшы, што Aβ 1-42 змяняе пранікальнасць мембраны і марфалогію мікробных клетак, што прыводзіць да іх гібелі.У дадатак да свайго прамога антымікробнага дзеяння, Aβ 1-42 можа таксама мадуляваць прыроджаны імунны адказ і прыцягваць запаленчыя клеткі да месца інфекцыі.Сосія і інш.(PLoS One, 2010) выявілі гэтую ролю, паведамляючы, што Aβ 1-42 стымулюе выпрацоўку празапаленчых цітокінаў і хемокінаў, такіх як інтэрлейкін-6 (IL-6), фактар некрозу пухліны-альфа (TNF-α), манацыты хемоаттрактантный бялок-1 (MCP-1) і макрофагального запаленчы бялок-1 альфа (MIP-1α), у мікрагліі і астрацытах, асноўных імунных клетках галаўнога мозгу.
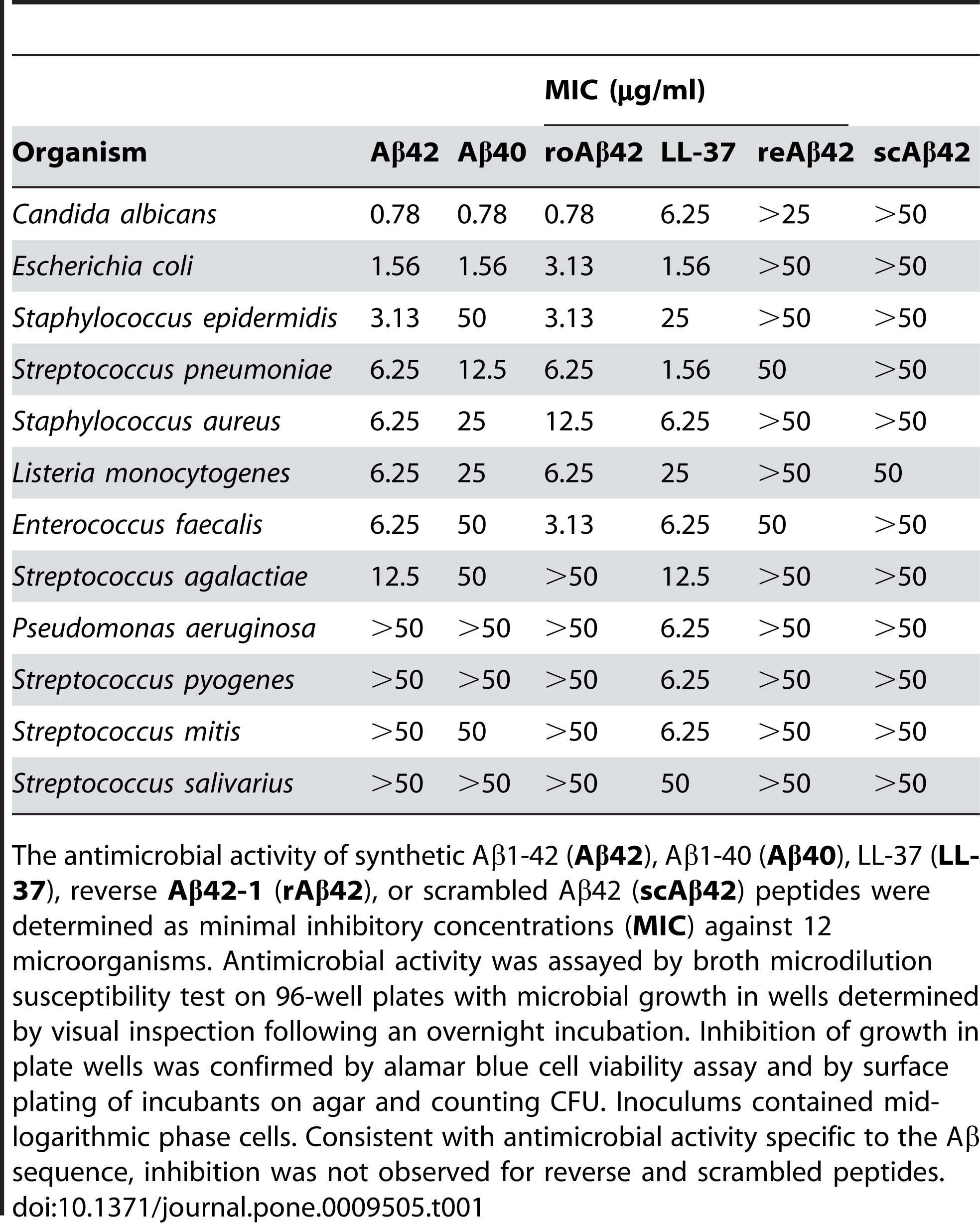
Малюнак 2. Пептыды Aβ валодаюць антымікробнай актыўнасцю.
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. Бэта-амілаідны бялок, звязаны з хваробай Альцгеймера, з'яўляецца антымікробным пептыдам. PLoS One 2010, 3 сакавіка;5(3):e9505.)
У той час як некаторыя даследаванні паказваюць, што назапашванне Aβ у галаўным мозгу можа быць ахоўнай рэакцыяй на хранічныя інфекцыі або траўмы, паколькі Aβ можа дзейнічаць як антымікробны пептыд (AMP) і ліквідаваць патэнцыйныя патагены, складанае ўзаемадзеянне паміж Aβ і мікробнымі элементамі застаецца тэма расследавання.Далікатны баланс падкрэсліваецца даследаваннем Moir et al.(Journal of Alzheimer's Disease, 2018), які сведчыць аб тым, што незбалансаваная або празмерная выпрацоўка Aβ можа ненаўмысна нанесці шкоду клеткам і тканінам гаспадара, што адлюстроўвае складаную дваістую прыроду ролі Aβ у інфекцыі і нейрадэгенерацыі.Празмерная або нерэгуляваная выпрацоўка Aβ можа прывесці да яго агрэгацыі і адкладу ў галаўным мозгу, утвараючы таксічныя алігамеры і фібрылы, якія пагаршаюць функцыю нейронаў і выклікаюць нервовае запаленне.Гэтыя паталагічныя працэсы звязаны са зніжэннем кагнітыўных здольнасцей і стратай памяці пры хваробы Альцгеймера, нейрадэгенератыўным захворванні, якое характарызуецца прагрэсавальнай дэменцыяй.Такім чынам, баланс паміж карысным і шкодным уздзеяннем Aβ мае вырашальнае значэнне для падтрымання здароўя мозгу і прадухілення нейрадэгенерацыі.
3. Экспарт жалеза: Было паказана, што Aβ 1-42 удзельнічае ў рэгуляцыі гамеастазу жалеза ў галаўным мозгу.Жалеза з'яўляецца неабходным элементам для многіх біялагічных працэсаў, але лішак жалеза таксама можа выклікаць акісляльны стрэс і нейрадэгенерацыю.Aβ 1-42 можа звязвацца з жалезам і палягчаць яго экспарт з нейронаў праз ферапартын, трансмембранны транспарцёр жалеза.Гэта можа дапамагчы прадухіліць назапашванне жалеза і таксічнасць у мозгу, паколькі лішак жалеза можа выклікаць акісляльны стрэс і нейрадэгенерацыю.Дучэ і інш.(Cell, 2010) паведамілі, што Aβ 1-42 звязаны з ферапартынам і павялічвае яго экспрэсію і актыўнасць у нейронах, што прыводзіць да зніжэння ўнутрыклеткавага ўзроўню жалеза.Яны таксама паказалі, што Aβ 1-42 зніжае экспрэсію гепсідыну, гармона, які інгібіруе ферапартын, у астрацытах, яшчэ больш узмацняючы экспарт жалеза з нейронаў.Аднак звязаны з жалезам Aβ можа таксама стаць больш схільным да агрэгацыі і адкладу ў пазаклеткавай прасторы, утвараючы амілаідныя бляшкі.Эйтан і інш.(Journal of Biological Chemistry, 2015) паведамляецца, што жалеза спрыяе адукацыі алігамераў Aβ і фібрыл in vitro і in vivo.Яны таксама паказалі, што хелатирование жалеза зніжае агрэгацыю і адклад Aβ у трансгенных мышэй.Такім чынам, баланс паміж карысным і шкодным уздзеяннем Aβ 1-42 на гамеастаз жалеза мае вырашальнае значэнне для падтрымання здароўя мозгу і прадухілення нейрадэгенерацыі.
Мы з'яўляемся вытворцам поліпептыдаў у Кітаі і маем шматгадовы вопыт вытворчасці поліпептыдаў.Hangzhou Taijia Biotech Co., Ltd. з'яўляецца прафесійным вытворцам поліпептыднай сыравіны, якая можа забяспечыць дзясяткі тысяч поліпептыднай сыравіны і можа быць настроена ў адпаведнасці з патрэбамі.Якасць поліпептыдных прадуктаў выдатная, а чысціня можа дасягаць 98%, што было прызнана карыстальнікамі ва ўсім свеце. Запрашаем пракансультавацца з намі.






